联系电话:
谢工 15622229311 (微同)
联系微信:

实验室污染之PCR污染如何处理
生物实验,大多数实验检测都是微观的,基于细胞,分子,蛋白水平,而这些微观样本对外界环境的影响敏感,比如温度、ph值、酶解、损伤等,在我们尽力呵护样本的生存环境的同时,污染也是需要注意的头等大事,要坚决避免环境中的“杂质”的乱入,包括样本污染,试剂仪器交叉污染、产物气溶胶污染等对实验结果的影响。“易查不易察”,污染来的悄无声息,防不胜防,假阳性结果让无数生物学子抓狂和崩溃。
在众多的生物实验室,分子生物学检测方法如PCR因其高灵敏度、快速、操作方便等优势已经被广泛应用,不过正是由于它灵敏度极高,极微量的污染源都有可能导致检测结果的假阳性,所以对环境污染的控制也极为严格。 面对众多的污染源,比如样本交叉污染、试剂仪器交叉污染、克隆质粒污染、PCR扩增产物污染、还有极容易忽视的气溶胶污染,气溶胶是由固体或液体小质点分散并悬浮在气体介质中形成的胶体分散体系,在空气与液体面摩擦时,比如在操作时比较剧烈地摇动反应管,开盖时、吸样时及污染进样枪的反复吸样都可形成气溶胶而污染。据计算一个气溶胶颗粒可含48000拷贝,因而由其造成的污染是一个非常重要而被忽视的污染源。
虽然这些污染对PCR实验结果的影响已经受到了广泛重视,多数实验室对污染控制都采取了各种办法,比如 定期大扫除清理、划分操作区域、试剂分装、操作谨慎、重复实验、多角度验证结果。但是微量的核酸片段就能被扩增,所以对污染物的控制不仅仅是做到这些就能够杜绝和避免的, 关键是需要从源头控制。目前多数生物试验室,分子实验每天都在大规模进行,污染源已经无处不在,特异性的,非特异性的,同源的,非同源的,广泛分布在样本容器、实验室台面,试剂溶液中、仪器表面内管附着等等,你以为普通的清理就能解决这些污染源吗?必须是不行的, 实验室大拿们都为了清除这些污染源研究出好多种方法,整理跟大家共享。
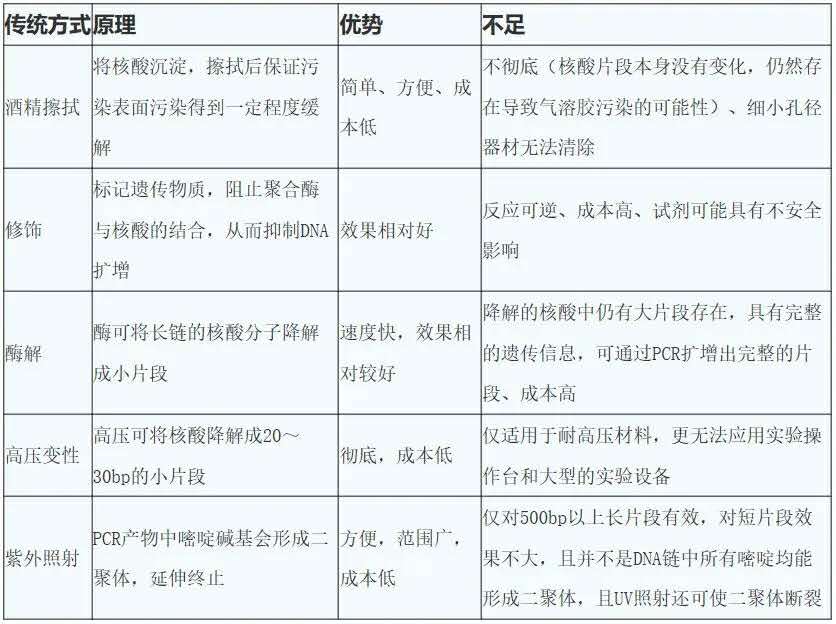
常见的防止污染的方法,推荐给大家:
合理的实验室分区
实验室内各工作区的实验用品,包括移液器等应专用。如有可能,应在装有紫外灯的层流式工作台(如生物安全柜、超净工作台)内,吸加PCR试剂,工作台内应放置PCR专业用的微量离心机、一次性手套、各量程的移液器和其他必须物品。
正确的实验操作
吸加PCR试剂和模板的操作应严格按要求进行,吸样要慢,尽量一次性完成,忌多次抽吸,以免交叉污染或产生气溶胶污染。
实验的过程中应勤换手套,在进出不同区域或进行模板操作后,都应及时更换手套。
装有PCR试剂的微量离心管在打开之前应先做瞬时离心(约10s),将管壁及管盖上的液体甩至管底部,从而减少污染手套或加样器的机会。开管动作要轻,以防管内液体溅出或形成气溶胶,造成污染。
在同时进行多个PCR反应时,应制备主反应混合液,再分装至PCR反应管,最后添加样品核酸模板,以减少单个添加操作繁琐造成的污染。
实验器具和试剂
实验室自己配置的试剂,如去离子水、缓冲液等,在使用之前均应高压灭菌或过滤除菌。
分装PCR试剂:所有的PCR试剂都应小量分装,以减少重复取样次数,并置于-20℃保存,适当时,最好做到专人专用。另外,PCR试剂、PCR反应液应与样品及PCR产物分开保存,不应放于同一冰盒或冰箱。
所有吸头、反应管等应一次性使用,使用之前,都应经过高压处理。若条件允许,最好使用带滤器的枪头。各工作区内的移液器要有标识,应固定使用用途,不能交叉使用。
实验设计
实验设计方面应遵循实验室内部质量控制的相关规定,实验中至少应:
设置目标DNA阳性对照反应。对靶序列所作的适当的稀释工作应于实验前在实验室内别的位置进行,这样可防止将靶DNA的浓溶液带到实验室中专门进行PCR的位置。
设置PCR试剂阴性对照和目标DNA阴性对照反应。
转载自:病毒学界

